目錄
簡介
現行治療阿茲海默症的用藥有以下三個類別:
- 膽鹼酯酶抑制劑(cholinesterase inhibitors) – donepezil、galantamine、rivastigmine
- NMDA受體拮抗劑(N-methyl-D-aspartate receptor antagonist) – memantine
- 單株抗體 – aducanumab(2021.06 FDA approved)
FDA在2023年7月06日正式核准Leqembi(lecanemab-irmb)用於阿茲海默症治療。Lecanemab-irmb為一種人源化IgG1單株抗體(humanized immunoglobulin gamma 1 monoclonal antibody),能夠直接針對可溶及不可溶聚集的β 型澱粉樣蛋白產生作用。由於β 型澱粉樣胜肽沉積組成的澱粉樣斑塊與造成神經細胞壞死,導致阿茲海默症症狀有關,因此透過減少β 型澱粉樣斑塊,能夠減少阿茲海默症的病理變化,改善認知程度。
Leqembi治療阿茲海默症療效的研究主要有以下2篇:
- Phase 2 – Swanson, Chad J et al. “A randomized, double-blind, phase 2b proof-of-concept clinical trial in early Alzheimer’s disease with lecanemab, an anti-Aβ protofibril antibody.” Alzheimer’s research & therapy vol. 13,1 80. 17 Apr. 2021, doi:10.1186/s13195-021-00813-8
- Phase 3 – Van Dyck, Christopher H., et al. “Lecanemab in early Alzheimer’s disease.” New England Journal of Medicine 388.1 (2023): 9-21.
Phase 2 trial為一篇隨機分派的雙盲試驗,是Leqembi的dose-finding trial,因此參與試驗的患者被區分成多個組別,分別給予2.5 mg/BIW、5 mg/QM、5 mg/BIW、10 mg/QM、10 mg/BIW、placebo等不同劑量。研究使用ADCOMS評分量表來評估患者疾病惡化程度(從0分到1.97分,分數越高代表疾病惡化越嚴重)。該研究原先目標設定為12個月時,治療組與對照組應達到八成患者疾病惡化程度減緩25%以上。雖然最終只有64%患者達到此標準,但在使用18個月後,研究觀察到澱粉樣蛋白清除與Leqemib的使用劑量及時間的關聯性(dose- and time-dependent)。衡量治療效果及發生澱粉樣蛋白相關影像異常(amyloid-related imaging abnormalities, ARIA),與腦水腫相關副作用(ARIA-E)發生的比例後,該研究建立合適的治療劑量為lecanemab 10 mg/kg intravenous infusion QOW。
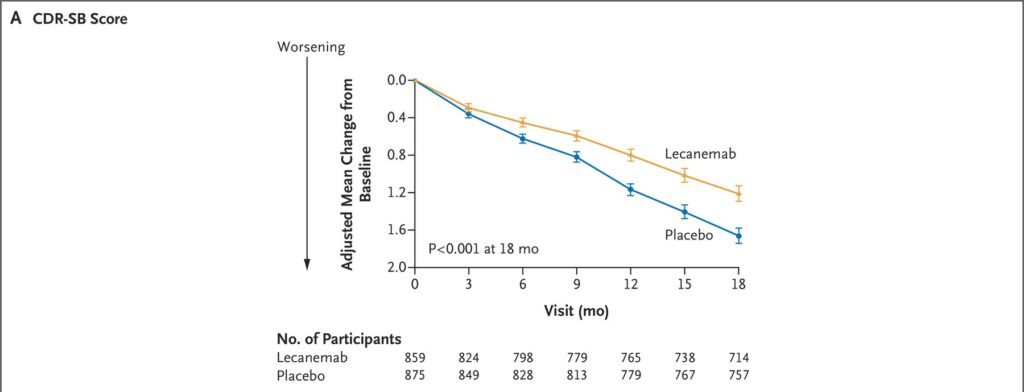
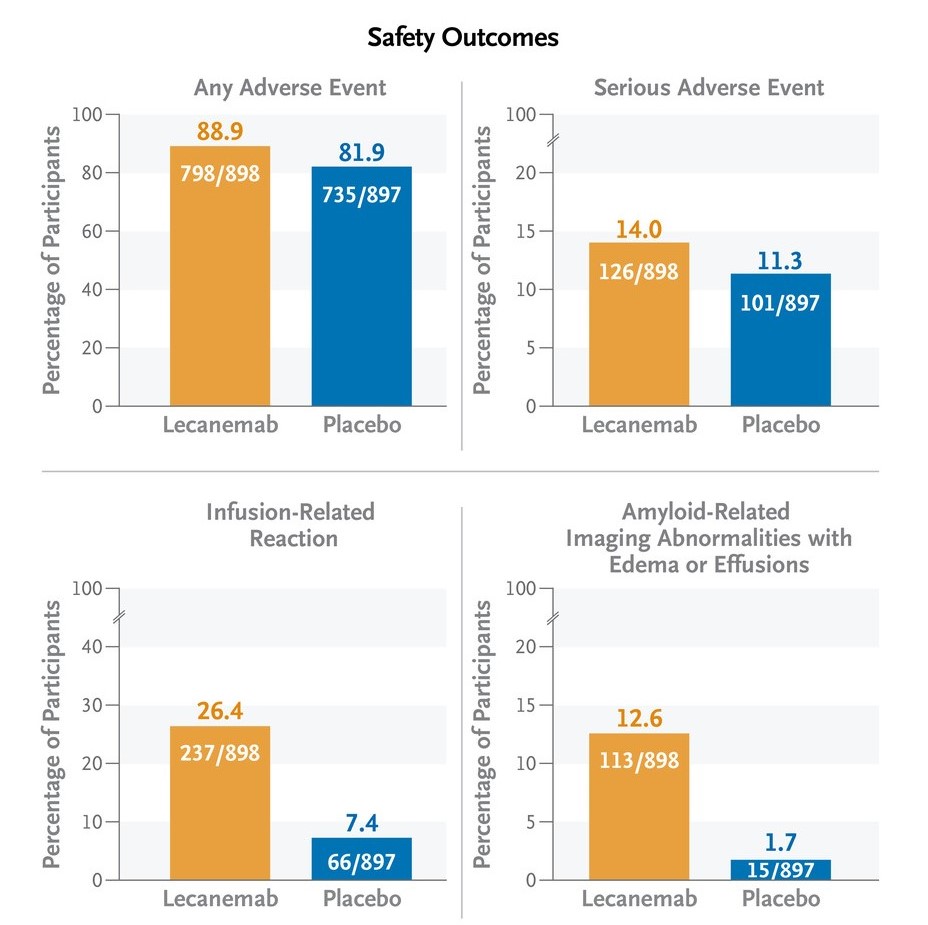
Phase 3 的研究為一偏多中心、雙盲、與安慰劑比較的隨機分配性試驗,目的是確認lecanemab的療效及安全性。研究收納了1795為年齡介於50-90歲的阿茲海默症患者,分別給予lecanemab 10 mg/kg IV QOW或安慰劑。該研究的primary看的是CDR-SB Score的改變(數字越大代表越嚴重)。雖然在18個月後兩組患者的CDR-SB Score都有變差的趨勢,但lecanemab組下降的幅度較小。安全性方面,lecanemab組發生輸注相關不良反應及ARIA的比例較高,但兩組在整體副作用發生率上比例接近。
治療劑量與給藥方式

- 建議劑量:10 mg/kg intravenous infusion every 2 weeks
- 稀釋方式:diluted in 250 mL of 0.9% sodium chloride injection
- 輸注速率:each infusion last about 1 hour
建議稀釋後立即給藥,若無法馬上給予,稀釋後不論在 2°C to 8°C或室溫皆能保存4小時。
目前建議Lequmbi應在患者出現輕度認知障礙時開始治療,不過尚未有早期或晚期介入的療效比較的資料。
注意事項
1、使用Leqembi可能發生澱粉樣蛋白相關影像異常(amyloid-related imaging abnormalities, ARIA)副作用,治療開始前應先進行腦部MRI,並在第5、7、14賜給藥前再次檢查。若患者用藥後出現ARIA-edema,應根據臨床症狀決定是否要繼續給予下一次劑量。
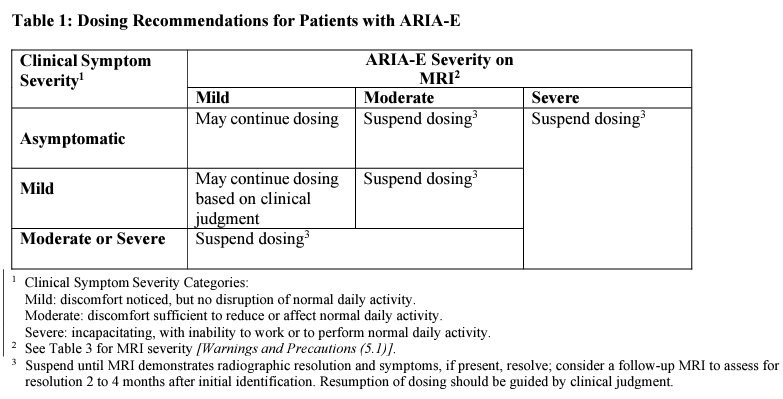
若患者出現ARIA-haemosiderin,同樣也是根據患者臨床症狀嚴重程度來決定是否給予下一次劑量。
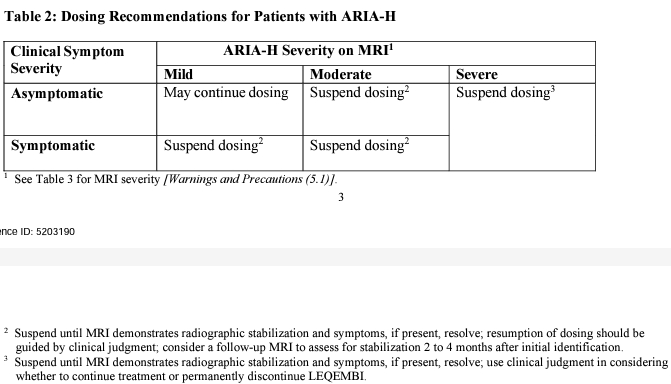
基於可能出現ARIA不良反應,應提醒患者若出現頭痛、意識混亂、譫妄、暈眩、視力改變、噁心嘔吐等症狀時需提高警覺。
2、與先前核准的單株抗體aducanumab相同,攜帶ApoE ε4 等位基因純合子(homozygous for the ApoE ε4 allele)患者的 ARIA 發生率較高。
3、Phase 3研究中使用Leqemib組別發生intracerebral hemorrhage比例較高(0.7%),應留意有無相關副作用。
4、雖然凝血藥物並非Leqembi使用的禁忌,但由於研究顯示Leqembi的患者使用抗凝藥物與腦出血數量增加相關,因此在服用抗凝劑或存在其他腦出血危險因素的患者中考慮使用Leqembi時應謹慎。
5、留意hypersensitivity reactions(angioedema, bronchospasm, anaphylaxis)。
6、留意infusion-related reactions (flu-like symptoms, nausea, vomiting, hypotension, hypertension, and oxygen desaturation)。
7、Leqembi需要冷藏(2-8°C)避光貯存 。
常見不良反應
- Infusion-related reactions
- Amyloid related imaging abnormality-microhemorrhages
- Amyloid related imaging abnormalityedema/effusion
- Headache
自動引用通知: 失智症簡介與藥物治療選擇 | 少年維特藥學部落格 - 臨床到生活的藥學知識
自動引用通知: 圓禿治療新選擇,美國FDA核准baricitinib與ritlecitinib用於嚴重圓禿治療 – 少年維特藥學部落格